Thông cáo của Bộ Y tế cho biết ngày 4/3/2020 đã cấp phép sử dụng tạm thời cho 2 bộ sinh phẩm Realtime PCR chẩn đoán nCoV (gồm LightPoweriVA SARS-CoV-2 1st RT-PCR Kit, và LightPoweriVA SARS-CoV-2 1st RT-rPCR Kit), thời hạn 6 tháng để sử dụng trong xét nghiệm sàng lọc.
Đến ngày 4/12/2020, Bộ Y tế cấp phép lưu hành 5 năm đối với bộ kit LightPoweriVA SARS-CoV-2 1st RT-rPCR Kit của Việt Á. Cũng tại quyết định này, Bộ Y tế cấp phép lưu hành bộ kit One-Step RT- PCR COVID-19 Kit Thai Duong Multiplex-3 target genes Version 1.0 của Công ty cổ phần Sao Thái Dương.
Tính đến ngày 20/12, Bộ Y tế đã cấp phép 146 sinh phẩm xét nghiệm nCoV, trong đó có 46 sinh phẩm xét nghiệm vật liệu di truyền (PCR, LAMP) tương tự sản phẩm của Việt Á và Sao Thái Dương (bao gồm 7 sinh phẩm sản xuất trong nước và 39 sinh phẩm nhập khẩu).
Bộ Y tế xác định việc cấp phép cho nhiều sản phẩm là để tăng cường nội địa hóa, chủ động nguồn cung và tạo sự cạnh tranh về giá sinh phẩm xét nghiệm. "Tất cả sản phẩm cấp phép đều đã được đánh giá đạt yêu cầu, đáp ứng tiêu chuẩn, chất lượng của Việt Nam và đảm bảo đúng theo các quy định hiện hành. Các sản phẩm sau khi được cấp phép đều được theo dõi chất lượng và tính ổn định", Bộ Y tê nêu.
Bộ Y tế cũng cho rằng việc cấp phép đối với sản phẩm của Việt Á và các nhà sản xuất khác không phụ thuộc vào danh sách do Tổ chức Y tế Thế giới (WHO) công bố. Lý do là, mỗi quốc gia, tổ chức đều xây dựng tiêu chí và yêu cầu về hồ sơ, sản phẩm khác nhau về việc chấp thuận lưu hành sinh phẩm. Các công ty có nhu cầu lưu hành, sử dụng tại quốc gia và tổ chức nào sẽ nộp hồ sơ theo quy định của từng tổ chức, quốc gia đó. Công ty mong muốn sản phẩm của mình được đưa vào danh sách của WHO thì nộp hồ sơ đề nghị WHO xem xét.
Đến nay, sinh phẩm xét nghiệm PCR, theo danh sách sử dụng khẩn cấp (EUL) của WHO có 23 sản phẩm được phê duyệt; trong khi đó, châu Âu đã chấp thuận 589 loại, Mỹ chấp thuận sử dụng 276 loại, Hàn Quốc chấp thuận 31 sinh phẩm loại...
Bộ Y tế cũng cho biết, trang thiết bị y tế và sinh phẩm xét nghiệm không thuộc trong danh mục mặt hàng phải quản lý giá. Giá trang thiết bị y tế và sinh phẩm xét nghiệm được xác định thông qua đấu thầu, giá các sản phẩm khác nhau theo từng thời điểm và số lượng mua sắm, khả năng cung ứng.
Thời điểm Công ty Việt Á niêm yết giá trên Cổng công khai giá là 470.000 đồng/sản phẩm, thì Công ty Sao Thái Dương niêm yết giá loại xét nghiệm PCR là 300.000 đồng/sản phẩm và xét nghiệm LAMP giá 385.000 đồng/sản phẩm, Công ty Ampharco U.S.A giá 179.800 đồng/sản phẩm; 15 sản phẩm PCR nhập khẩu đã được cấp phép đăng ký và niêm yết giá từ 280.000 đồng đến 600.000 đồng/sản phẩm.
"Thông tin này đã được công khai trên Cổng công khai giá để các địa phương, cơ sở y tế nắm bắt, tham khảo khi xây dựng kế hoạch và thực hiện mua sắm, đấu thầu, sử dụng sản phẩm phục vụ nhu cầu phòng, chống dịch, mà không phải là giá bắt buộc áp dụng. Các địa phương, đơn vị thực hiện mua sắm, đấu thầu theo đúng quy định và chịu trách nhiệm về kết quả thực hiện", Bộ Y tế lý giải.
Hiện tại, Cổng công khai giá trang thiết bị y tế có trên 1.600 doanh nghiệp công khai giá bán (giá niêm yết theo quy định của Luật giá), hơn 60.000 mặt hàng trang thiết bị y tế công khai giá (8.256 thiết bị y tế; 36.191 vật tư y tế; 15.584 IVD) và 93.253 kết quả trúng thầu.
Bộ Y tế cho biết đã trình Chính phủ ban hành Nghị định 98 (có hiệu lực thi hành từ ngày 1/1/2022), trong đó quy định giá sinh phẩm xét nghiệm thuộc mặt hàng quản lý giá. Chính phủ cũng đã trình Ủy ban Thường vụ Quốc hội đưa trang thiết bị, sinh phẩm y tế phòng chống dịch Covid-19 vào mặt hàng bình ổn giá.
Công tác phòng, chống dịch ở Việt Nam được thực hiện theo phương châm "4 tại chỗ". Các địa phương chủ động mua sắm, đấu thầu trang thiết bị y tế đáp ứng nhu cầu phòng, chống dịch trên địa bàn. Việc thực hiện mua sắm vật tư, trang thiết bị, sinh phẩm y tế căn cứ theo quy định của pháp luật. Trên cơ sở đó, các địa phương, đơn vị phải thực hiện việc đấu thầu mua sắm theo quy định hiện hành của Nhà nước và tự chịu trách nhiệm về việc mua sắm này.
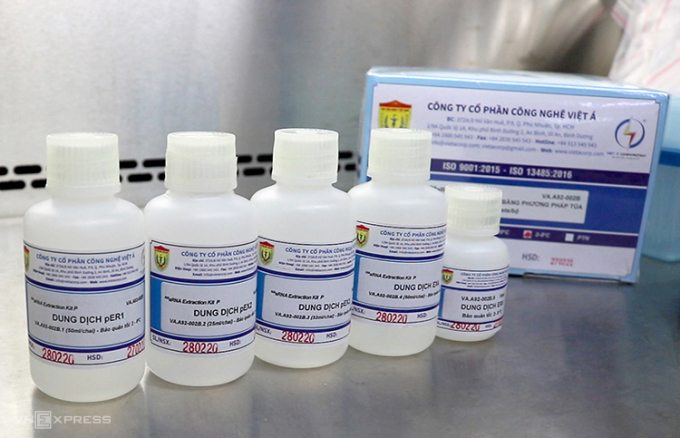
Bộ Y tế đánh giá "việc nâng khống giá bộ xét nghiệm Covid-19 của Công ty cổ phần Công nghệ Việt Á là rất nghiêm trọng, cần phải được xử lý nghiêm minh".
Ngày 18/12, Cơ quan Cảnh sát điều tra (C03, Bộ Công an) khởi tố ông Phan Quốc Việt, Chủ tịch HĐQT kiêm Tổng giám đốc Công ty Cổ phần công nghệ Việt Á cùng một số thuộc cấp gồm: Hồ Thị Thanh Thảo (thủ quỹ, kiêm cửa hàng trưởng Âu Lạc), Phan Tôn Noel Thảo (trợ lý tài chính), Trần Thị Hồng (nhân viên kinh doanh) để làm nghi vấn phạm tội Vi phạm quy định về đấu thầu gây hậu quả nghiêm trọng.
Cùng tội danh, C03 khởi tố ông Phạm Duy Tuyến (Giám đốc Trung tâm Kiểm soát bệnh tật Hải Dương - CDC tỉnh Hải Dương) và Nguyễn Mạnh Cường (nguyên kế toán trưởng CDC Hải Dương).
Điều tra ban đầu xác định, tháng 4/2020, Công ty Cổ phần công nghệ Việt Á được Bộ Y tế cấp phép đăng ký lưu hành sản phẩm kit xét nghiệm Covid-19. Doanh nghiệp đã cung ứng kit cho 62 tỉnh, thành phố, doanh thu gần 4.000 tỷ đồng.
Nhằm thu lợi nhuận bất chính và chi tiền ngoài hợp đồng, Việt cùng các nhân viên Việt Á nâng khống giá thiết bị, chi phí nguyên vật liệu đầu vào, xác định giá bán là 470.000 đồng/kit.
Nguồn tin: vnexpress.net
Chính phủ Covid Covid-19 Công an Công nghệ Nghị định Việt Nam doanh nghiệp kế toán sản xuất
Bài viết liên quan
 HƯỞNG ỨNG PHONG TRÀO CHUYỂN ĐỔI SỐ MẠNH MẼ TRONG GIỚI DOANH NGHIỆP HIỆN ĐẠI TOÀN CẦU, ĐÃ ĐẾN LÚC PHẢI XÂY DỰNG 1 WEBSITE TIÊU CHUẨN WEB3 OMNIVERSE/OMNICHANNEL CHUYÊN NGHIỆP!
HƯỞNG ỨNG PHONG TRÀO CHUYỂN ĐỔI SỐ MẠNH MẼ TRONG GIỚI DOANH NGHIỆP HIỆN ĐẠI TOÀN CẦU, ĐÃ ĐẾN LÚC PHẢI XÂY DỰNG 1 WEBSITE TIÊU CHUẨN WEB3 OMNIVERSE/OMNICHANNEL CHUYÊN NGHIỆP!  SW3S CUNG CẤP HỆ THỐNG PHẦN MỀM CỤC BỘ TẠI CHỖ VÀ CÁC PHẦN MỀM ONCLOUD ONLINE CHO DOANH NGHIỆP. LIÊN HỆ NGAY ĐỂ ĐƯỢC TƯ VẤN VÀ DÙNG THỬ SẢN PHẨM / HỆ THỐNG MIỄN PHÍ
SW3S CUNG CẤP HỆ THỐNG PHẦN MỀM CỤC BỘ TẠI CHỖ VÀ CÁC PHẦN MỀM ONCLOUD ONLINE CHO DOANH NGHIỆP. LIÊN HỆ NGAY ĐỂ ĐƯỢC TƯ VẤN VÀ DÙNG THỬ SẢN PHẨM / HỆ THỐNG MIỄN PHÍ  Doanh nhân Tổng đốc Hoàng Trọng Phu Người khôi phục và đưa thương hiệu thủ công Việt Nam ra thế giới (Kỳ 2)
Doanh nhân Tổng đốc Hoàng Trọng Phu Người khôi phục và đưa thương hiệu thủ công Việt Nam ra thế giới (Kỳ 2)  Ông Phan Nguyễn Như Khuê Doanh nhân là thành tố quan trọng góp phần xây dựng không gian văn hóa Hồ Chí Minh
Ông Phan Nguyễn Như Khuê Doanh nhân là thành tố quan trọng góp phần xây dựng không gian văn hóa Hồ Chí Minh  Chủ tịch UBND TP.HCM Phan Văn Mãi Đội ngũ doanh nhân đã nâng cao vị thế kinh tế của TP.HCM với cả nước và quốc tế
Chủ tịch UBND TP.HCM Phan Văn Mãi Đội ngũ doanh nhân đã nâng cao vị thế kinh tế của TP.HCM với cả nước và quốc tế 
Bấm để xem thêm ...
MARKETPLACE
NHÓM MUA TRỰC TUYẾN PHIÊN CHỢ TRỰC TUYẾN ĐẤU GIÁ TRỰC TUYẾN SEAONER NFT MALL SEAONER AI MALL SEAONER DATACENTER MALL SEAONER TOP TECH MALL MÁY BỘ VI TÍNH DỊCH VỤ IT & MORES ROSA PC MALL ROSA e-COMMERCE ĐỒ HỌA & LÀM PHIM MÁY VĂN PHÒNG MÁY CHIẾU PHIM 4K/8K LINH KIỆN VI TÍNH GAMING GEARS PHỤ KIỆN VI TÍNH CLB4U SDK PLATFORM LẬP TRÌNH WEB3 APP DỰ ÁN AI MÁY CHỦ DOANH NGHIỆP CLOUD SERVER & HOSTING DATACENTER TRANG THIẾT BỊ AI THIẾT BỊ HIỂN THỊ THÔNG MINH GAMES & PHÒNG GAME CHUYỂN ĐỔI SỐ THIẾT BỊ KỸ THUẬT SỐ THIẾT BỊ ÂM THANH ÁNH SÁNG SMARTHOME & SMART OFFICE CÀ PHÊ NHÀ HÀNG CARS & MORES BIKES & MORES THỜI TRANG & CUỘC SỐNG THỰC PHẨM ORGANIC BEER COFFEE TEA LOUNGE GLAMPING & CAMPING THỰC PHẨM TƯƠI SỐNG NỘI NGOẠI THẤT & KIẾN TRÚC DU LỊCH & CUỘC SỐNG THỰC PHẨM CHỨC NĂNG THIẾT BỊ GIA DỤNG ĐIỆN THOẠI & PHỤ KIỆN MẸ & BÉ THỦ CÔNG MỸ NGHỆ & MỸ THUẬT KẾT NỐI DOANH NGHIỆP SỬA CHỮA BẢO TRÌ & DỊCH VỤ TRANH ẢNH & NGHỆ THUẬT KẾ TOÁN & THUẾ & THÀNH LẬP DN NÔNG NGHIỆP THÔNG MINH NÔNG SẢN SÀN NÔNG NGHIỆP SIÊU THỊ THỰC PHẨM SẠCH THIẾT KẾ & IN ẤN THỰC PHẨM KHÔ & ĐÓNG GÓI THỦY HẢI SẢN THỦY HẢI SẢN & NUÔI TRỒNG TRẠM XĂNG VĂN PHÒNG PHẨM VỆ SINH CÔNG NGHIỆP & CHUYỂN NHÀ XÂY DỰNG & CẢI TẠO CÔNG TRÌNH XÂY DỰNG & VẬT LIỆU XÂY DỰNG
Thể loại giao dịch
Cần Bán Cần Mua Dịch vụ SaaS Affiliate Marketing Dịch vụ AIaaS Cho thuê Dịch vụ XaaS Dịch vụ PaaS Dịch Vụ Dịch vụ IaaS Tư vấn Đấu Giá Đấu Giá Trực Tuyến Đấu Thầu Ký Gửi Nhóm Mua Thi Công Trao Đổi Dịch Vụ Trao Đổi Sản Phẩm Xuất Nhập Khẩu Xúc Tiến Thương Mại